Ester dibuat dengan mereaksikan alkohol
atau fenol dengan asam karboksilat kemudian direfluks. Fenol yaitu senyawa
organik dimana gugus -OH langsung terikat pada cincin benzena. Reaksi pembuatan
ester disebut esterifikasi dan reaksi yang terjadi
disebut reaksi esterifikasi Fischer. Reaksi
esterifikasi merupakan reaksi reversibel yang sangat lambat, tetapi bila
menggunakan katalis asam mineral seperti asam sulfat (H2SO4)
dan asam klorida (HCl) kesetimbangan akan tercapai dalam waktu yang cepat. Pola
umum dalam pembuatan ini dinyatakan dengan persamaan berikut
RCOOH + R1OH ↔ RCOOR1 + H2O
Dalam reaksi esterifikasi, ion H+ dari
H2SO4 berperan dalam pembentukan ester dan juga
berperan dalam reaksi sebaliknya yakni hidrolisis ester. Sesuai dengan hukum
aksi massa, untuk memperoleh rendemen ester yang tinggi maka kesetimbangan
harus bergeser ke arah pembentukkan ester. Untuk mencapai keadaan ini dapat
ditempuh dengan cara:
a. Salah satu pereaksi digunakan secara berlebih. Biasanya alkohol
dibuat berlebih karena murah dan mudah diperoleh.
b. Membuang salah satu produk dari dalam campuran reaksi
Laju reaksi esterifikasi suatu asam karboksilat bergantung pada halangan sterik
dalam alkohol dan asam karboksilatnya.
Dengan bertambahnya halangan sterik di
dalam zat antara, laju pembentukkan ester akan menurun. Dengan demikian
rendemen ester akan berkurang.
Esterifikasi dipengaruhi oleh beberapa
faktor, diantaranya adalah struktur molekul dari alkohol, suhu dan konsentrasi
reaktan maupun katalis. Kereaktifan alkohol terhadap esterifikasi: CH3OH
> alkohol primer > alkohol sekunder > alkohol tersier
Kereaktifan asam karboksilat terhadap esterifikasi : HCOOH > CH3COOH
> RCH2COOH > R2CHCOOH > R3CCOOH
Selain dibuart dari asam karboksilat,
ester juga dapat diperoleh dengan cara mereaksikan suatu klorida asam atau
suatu anhidrida asam dengan alkohol atau fenol. Reaksi pembuatan ester dari
klorida asam dan anhidrida asam mengikuti pola umum reaksi berikut.
Klorida asam
RCOCl + R1OH → RCOOR1 + HCl
RCOCl + ArOH → RCOOAr + HCl
Anhidrida asam
(RCO)2O + R1OH → RCOOR1 +
RCOOH
(RCO)2O + ArOH → RCOOAr + RCOOH
REAKSI-REAKSI ESTER
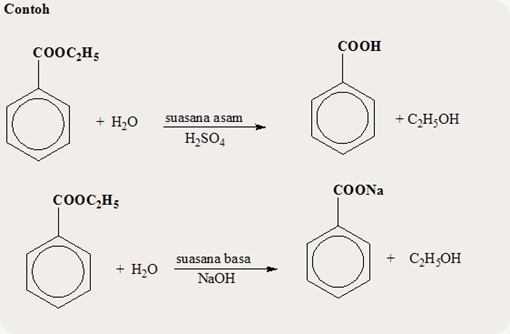
a. Reaksi hidrolisis
Reaksi hidrolisis ester dalam suasana
asam menghasilkan asam karboksilat dan alkohol, namun bila reaksi hidrolisis
dilangsungkan dalam suasana basa diperoleh garam karboksilat dan alkohol.
Hidrolisis ester dengan basa dise4but reaksi Penyabunan (Saponifikasi).
 b. Reaksi dengan Amonia
b. Reaksi dengan Amonia
Produk reaksi antara ester dengan amonia
adalah suatu amida dan suatu alkohol.Contoh : reaksi antara etil asetat dengan
amonia menghasilkan asetamida dan etanol.
CH3COOC2H5 + NH3 →
CH3CONH2 + C2H5OH
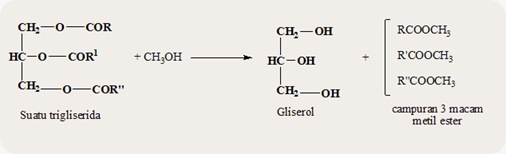
c. Transesterifikasi
Jika suatu ester direaksikan dengan
suatu alkohol maka akan diperoleh ester baru dan alkohol baru. Reaksi ini
disebut reaksi transesterifikasi yang dapat berlangsung dalam suasana asam dan
basa mengikuti pola umum berikut ini.
RCOOR1 + R”OH ↔ RCOOR” + R1OH
Reaksi diatas disebut transesterifikasi
karena terjadi pertukaran antara gugus alkil dalam –OR1 pada
ester dengan gugus alkil dalam ikatan R”O.
Contoh reaksi antara suatu trigliserida dengan metanol.
 d. Reaksi dengan pereaksi Grignard
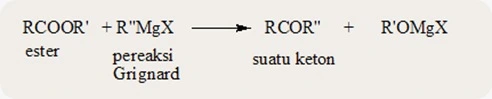
d. Reaksi dengan pereaksi Grignard
Reaksi antara suatu ester dengan
pereaksi Grignard merupakan cara istimewa dalam pembuatan alkohol tersier. Pola
umum dari reaksi ini adalah sebagai berikut.
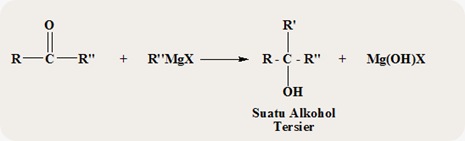
 Bila keton yang diperoleh di atas
direaksikan lebih lanjut dengan R’’MgX maka pada akhirnya diperoleh suatu
alkohol terseir menurut persamaan reaksi berikut ini.
Bila keton yang diperoleh di atas
direaksikan lebih lanjut dengan R’’MgX maka pada akhirnya diperoleh suatu
alkohol terseir menurut persamaan reaksi berikut ini.
Ester tidak bereaksi dengan ion halida
atau dengan ion karboksilat sebab nukleofil ini merupakan basa lebih lemah
daripada gugus pergi ester. Suatu ester bereaksi dengan air membentuk suatu
asam karboksilat dan alkohol. Ini merupakan suatu contoh reaksi hidrolisis –
suatu reaksi dengan air yang mengubah satu senyawa menjadi dua senyawa.

Suatu ester bereaksi dengan alkohol membentuk ester baru dan alkohol
baru. Ini merupakan contoh reaksi alkoholisis. Reaksi alkoholisis tertentu ini
disebut juga reaksi transesterifikasi sebab satu ester dirubah menjadi ester
lain.
 Hidrolisis dan alkoholisis dari suatu
ester merupakan reaksi sangat lambat sebab air dan alkohol merupakan nukleofil
lemah dan ester memiliki gugus pergi yang sangat basa. Hidrolisis dan
alkoholisis ester dapat dikatalisis dengan asam. Kecepatan hidrolisis dapat
ditingkatkan dengan ion hidroksida dan kecepatan alkoholisis dapat ditingkatkan
dengan basa konjugasi (RO¯) dari alkohol reaktan.
Hidrolisis dan alkoholisis dari suatu
ester merupakan reaksi sangat lambat sebab air dan alkohol merupakan nukleofil
lemah dan ester memiliki gugus pergi yang sangat basa. Hidrolisis dan
alkoholisis ester dapat dikatalisis dengan asam. Kecepatan hidrolisis dapat
ditingkatkan dengan ion hidroksida dan kecepatan alkoholisis dapat ditingkatkan
dengan basa konjugasi (RO¯) dari alkohol reaktan.
Ester juga bereaksi dengan amina
membentuk amida. Reaksi dengan amina mengubah satu senyawa menjadi dua senyawa
yang disebut aminolisis. Sebagai catatan bahwa aminolisis dari ester
membutuhkan hanya satu ekuivalen amina, tidak seperti aminolisis dari suatu
asil halida atau asam anhidrida, yang membutuhkan dua ekuivalen. ekuivalen. Reaksi dari ester dengan amina tidak
selambat reaksi dari ester dengan air dan alcohol, sebab amina merupakan
nukleofil yang lebih baik. Ini merupakan keuntungan sebab kecepatan reaksi dari
reaksi ester dengan amina tidak ditingkatkan dengan asam atau HO¯ atau
RO¯.
Reaksi dari ester dengan amina tidak
selambat reaksi dari ester dengan air dan alcohol, sebab amina merupakan
nukleofil yang lebih baik. Ini merupakan keuntungan sebab kecepatan reaksi dari
reaksi ester dengan amina tidak ditingkatkan dengan asam atau HO¯ atau
RO¯.
PERMASALAHAN:
11. Dalam artikel di atas dikatakan bahwa reaksi esterifikasi
merupakan reaksi reversibel yang sangat lambat, tetapi bila menggunakan katalis
asam mineral seperti asam sulfat (H2SO4) dan asam klorida
(HCl) kesetimbangan akan tercapai dalam waktu yang cepat.seperti yang kita
ketahui katalis adalah suatu zat yang dapat mempercepat reaksi, mengapa ketika
digunakan katalis asam mineral reaksi bisa berjalan sangat cepat, bagaimana
reaksi yang terjadi? dan bagaimana jika kita menggunakan katalis selain asam
misalnya basa, apakah akan cepat juga?
22. Ester juga bereaksi dengan
amina membentuk amida. Reaksi dengan amina mengubah satu senyawa menjadi dua
senyawa yang disebut aminolisis, bagaimana reaksi ini bisa terjadi? dan mengapa
aminolisis dari ester hanya membutuhkan satu ekuivalen amina,
tidak seperti aminolisis dari suatu asil halida atau asam anhidrida, yang membutuhkan
dua ekuivalen??.
.png)
.png)



.png)
.png)






