UJIAN MID SEMESTER
MATAKULIAH : Kimia Organik II
SKS : 3SKS
WAKTU : Mulai Rabu, 24 April sampai dengan 1 Mei 2013 jam 24.00
PENGAMPU : Dr. Syamsurizal, M.Si
SKS : 3SKS
WAKTU : Mulai Rabu, 24 April sampai dengan 1 Mei 2013 jam 24.00
PENGAMPU : Dr. Syamsurizal, M.Si
PERHATIAN: UJIAN INI DIIZINKAN UNTUK MEMBUKA BUKU, BROWSING INTERNET, ANDA DILARANG MENCONTEK JAWABAN TEMAN ATAU COPY PASTE ARTIKEL TERKAIT DI INTERNET. ANDA HARUS MENGKONSTRUKSI JAWABAN SENDIRI SESUAI DENGAN KEMAMPUAN PENALARAN MASING-MASING. Semua jawaban diposting di blog anda masing-masing, lengkapi profil anda dengan foto agar mudah dikenali.
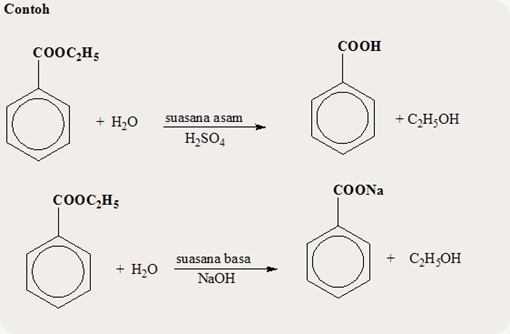
1. Asam karboksilat dapat ditransformasi menjadi beberapa turunan. Buatlah skema reaksi perubahan dari suatu ester menjadi amida selanjutnya target akhirnya adalah benzoil khlorida.
jawab:Skema reaksi perubahan dari suatu ester menjadi amida adalah sebagai berikut:
Amonolisa==>amida
Amonolisa==>amida
Reaksi di atas Etil etanoat yang merupakan sebuah ester ditambahkan dengan amonia akan menghasilkan suatu amida yaitu benzamida dan suatu alkohol yaitu etanol. Jika kita ingin menghasilkan produk sebuah benzoil klorida maka reaksinya dapat dilihat sebagai berikut:
Benzamida yang dihasilkan
dari reaksi antara etil etanoat dengan amonia jika direaksikan kembali dengan
amonium klorida maka akan menghasilkan produk sebuah benzoil klorida dan dua
amonia
2. Temukan manfaat dari
benzoil khlorida, jelaskan bagaimana mekanisme senyawa benzoil khlorida
berperan.
jawab:
Manfaat dari benzoil khlorida sebagai zat warna,parfum, peroksida, obat-obatan dan untuk mensintesis senyawa lain.
Saya ambil contoh yaitu peran benzoil klorida dalam mensintesis senyawa lain yaitu dalam pembuatan 2-benzoiloksi-1,2,3-propanatrikarboksilat melalui esterifikasi antara asam 2-hidroksi-1,2,3-propanatrikarboksilat dengan benzoil klorida.
Dalam menyatukan antara benzoil klorida dengan asam sitrat (antara polar dan non polar) kita harus menggunakan pelarut yang sesuai sehingga keduanya dapat bersatu atau menggunakan cara lain yang bisa mereaksikan keduanya. Dalam sebuah penelitian bahwa kita dapat menyatukan keduanya dengan reaksi esterifikasi yang terlebih dahulu harus kita reaksikan asam sitrat dengan kalsium karbida membentuk kalsium disitrat dan kemudian baru direkasikan dengan benzoil klorida. Untuk menyatukan kedua senyawa ini menggunakan pelarut organik seperti kloroform. Tetapi tidak muutlak menggunakan kloroform saja tetapi juga bisa mengggunakan CCl4.
Reaksi yang terjadi yaitu sebagai berikut:
Reaksi yang terjadi yaitu sebagai berikut:
3. Bila benzoil khlorida dikonversi menjadi asam benzoat. Buatlah tiga contoh turunan asam benzoat sebagai model, kemudian jelaskan pengaruh efek resonansi terhadap kekuatan tiga jenis asam benzoat yang anda modelkan.
jawab:
saya mengambil contoh turunan asam benzoat sebagai model adalah sebagai berikut:
a. 2-4-diklorofenoksiasetat
4. Usulkan turunan asam benzoat yang anda gunakan pada soal no.3 dapat dibiodegradasi oleh suatu mikroorganisme, bagaimana hasil akhir penguraiannya?
jawab:
Saya mengusulkan bahwa 3-klorobenzoat sebagai contoh
senyawa turunan dari asam benzoat, 3-klorobenzoat ini akan dibiodegradasi oleh
mikroorganisme Desulfomonile
tiedjei, strain BZ-2 dan
Strain PM-1 (Methanospirillum)
Tahap-tahap penguraian senyawa 3-klorobenzoat ini adalah sebagai berikut:
- Klor pada klorobenzoat akan dihilangkan oleh bakteri Desulfomonile tiedjei, bakteri ini akan memanfaatkan unsur karbon yang ada pada 3-klorobenzena. Jadi, ketika mikrorganisme ini mengambil unsur karbon yang mengikat unsur klor maka ikatan antar keduanya akan terputuskan
- Mikroorganisme strain BZ-2 akan tumbuh dan berkembang ketika mendapatkan subtrat yang cocok untuk kelangsungan hidupnya, pada senyawa klorobenzoat ini terkandung subtrat yang dibutuhkan untuk kelangsungan hidupnya, sehingga mikroorganisme ini akan mengoksidasi klorobenzoat untuk mengambil subtrat yang terkandung didalam klorobenzoat itu sendiri.
- Bakteri ini tidak mampu melangsungkan reaksi katalis karena situasi termodinamik yang tidak mendukung, tetapi ketika dibantu oleh mikroorganisme Strain PM-1 (Methanospirillum) yang hanya menggunakan format atau hidrogen sebagai substrat. Caranya dengan menurunkan tekanan parsial gas hidrogen sehingga akan membentuk situasi termodinamik yang menguntungkan. tahap-tahap ini dapat dilihat pada gambar dibawah ini:








.png)
.png)



.png)
.png)